Bảng tuần hoàn hóa học ❤️ mẹo ghi nhớ
Phần kỹ năng về bảng tuần trả nguim tố chất hóa học cực kì quan trọng đối với các bạn học viên vào quá trình tiếp thu kiến thức môn hóa học, tuyệt nhất là đối với các bạn học sinh học kăn năn thoải mái và tự nhiên. Bài viết dưới đây nhằm giúp những bạn có thể dễ ợt phát âm được tất cả các phần lên tiếng kiến thức và kỹ năng của bảng này.
Bạn đang xem: Bảng tuần hoàn hóa học ❤️ mẹo ghi nhớ
Các hiệ tượng thu xếp những nguim tố trong bảng tuần hoàn hóa họcCấu chế tác chi tiết với cách hiểu bảng tuần hoàn nguim tố hóa học1. Ô nguyên ổn tố2. Chu kỳ3. Nhóm (ngulặng tố)Một số biện pháp ghi nhớ bảng tuần trả chất hóa học hiệu quả
Bảng tuần trả hóa học tuyệt còn được biết đến là bảng tuần trả Mendeleev là viết tắt của bảng tuần hoàn các nguyên tố hóa học. Bảng này biểu thị những ngulặng tố hóa học dựa Theo phong cách thu xếp số hiệu nguyên ổn tử của những nguyên tố (số proton), thông số kỹ thuật electron với những quy qui định tuần trả khác của chúng.

Bảng tuần hoàn hóa học được phát minh do Dimitri Mendeleev cùng được tạo ra áp dụng rộng rãi lần trước tiên vào năm 1869. Từ kia trsinh hoạt sau này, bảng tuần hoàn này được công bọn chúng chào đón và trở nên một tư liệu quan trọng đặc biệt cho những công trình khoa học. Nhờ vào bảng tuần hoàn hóa học này, nhỏ fan thời nay hoàn toàn có thể tiện lợi gọi về sự vận hành của các nguyên ổn tố với những quy hiện tượng không giống trong kỹ thuật.
Bảng tuần trả hóa học được thực hiện những năm bây chừ đã được sửa đổi cùng không ngừng mở rộng thêm vị sự phát hiện các nguim tố new khác. Tuy nhiên, về khía cạnh vẻ ngoài thì bảng tuần hoàn các nguyên tố chất hóa học hiện giờ vẫn giữ lại được đúng đa số đường nét cơ bạn dạng của bảng tuần hoàn nơi bắt đầu của Mendeleev.
Các hình thức bố trí những nguim tố vào bảng tuần trả hóa học
Trong bảng tuần hoàn các ngulặng tố hóa học, các nguim tố được sắp xếp theo một trơ trẽn tự nhất định theo những hình thức sau:
1. Sắp xếp những nguyên ổn tố theo nhóm
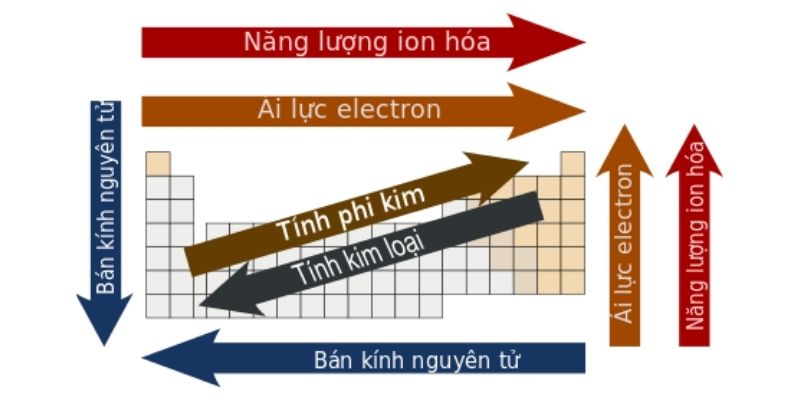
Nhóm (hoặc họ) là 1 trong những cột trong bảng tuần hoàn những ngulặng tố hóa học. Các nguyên tố xếp tầm thường một tổ sẽ sở hữu được thông số kỹ thuật electron đồng nhất vào lớp hóa trị với vì thế những ngulặng tố này sẽ có đặc thù chất hóa học giống như nhau. Trong một đội nhóm, số hiệu nguyên tử và nửa đường kính của các ngulặng tố đã tăng vọt từ bỏ bên trên xuống dưới. Do kia, nút tích điện của những nguim tử sẽ được đậy đầy rộng, những electron ngoài cùng cũng biến thành biện pháp xa hạt nhân hơn.
Đồng thời, xét từ trên xuống bên dưới, nút năng lượng ion hóa của những nguyên tử vẫn bớt dần, giỏi những electron phía bên cạnh đang thuận tiện bị tách thoát khỏi nguim tử hơn. Tương từ, vào một nhóm, nguyên ổn tử tất cả số hiệu nguyên ổn tử càng lớn thì độ âm điện càng bớt (loại trừ mang lại trường đúng theo nhóm 11).
2. Sắp xếp những ngulặng tố theo chu kỳ
Các ngulặng tố được chuẩn bị theo chu kỳ nghĩa là được bố trí thành một sản phẩm ngang vào bảng tuần hoàn. Theo chiều từ trái lịch sự cần, bán kính nguyên tử của ngulặng tố vẫn sút dần dần còn độ âm năng lượng điện cùng năng lượng ion hóa vẫn tăng dần đều bởi vì sự tăng nhiều của số proton vào phân tử nhân đã khiến cho e lớp bên ngoài cùng được kéo lại sát hơn

3. Sắp xếp theo phân nhóm
Có thể xếp các nguim tố trong bảng tuần trả những nguim tố hóa học vào 4 phân team khác nhau là s, p, d và f. Theo IUPAC, electron cuối cùng của nguyên tử nguim tố được điền vào phân lớp như thế nào (theo trình từ bỏ nút năng lượng) thì nguyên tố này sẽ thuộc phân team kia.
4. Một số giải pháp sắp xếp khác
Ngoài cha biện pháp bố trí những nguyên tố như trên, bạn ta có thể phân tách các ngulặng tố vào bảng tuần hoàn chất hóa học thành 3 nhiều loại là á klặng ,kim loại cùng phi kim.
Klặng nhiều loại là các hóa học rắn, có ánh klặng, có công dụng dẫn nhiệt cùng dẫn điện tốt. Các kim loại này rất có thể kết hợp với nhau hoặc kết hợp với phi kim sinh sản thành thích hợp chất. Và vào bảng tuần trả chất hóa học, sắt kẽm kim loại thường xuyên tốt được phân bổ sinh hoạt phía phía trái và dưới.
trái lại, phi klặng thường là các chất khí gồm màu hoặc ko màu, không có tác dụng dẫn nhiệt độ hay dẫn năng lượng điện. Phi kim thường kết phù hợp với nhau nhằm chế tạo thành vừa lòng chất hóa trị, cùng hay được xếp nằm phía bên đề nghị cùng phía bên trên của bảng tuần trả.
Còn lại, trung tâm kim loại và phi kyên ổn chính là những á kyên. Các nguim tố này thường xuyên sẽ có tính chất trung gian thân kim loại và phi kyên.
Cấu tạo ra chi tiết và biện pháp hiểu bảng tuần hoàn nguyên ổn tố hóa học
Tại thời điểm hiện nay, so với phiên bạn dạng 113 nguim tố chất hóa học. IUPAC đang thực hiện chuyển thêm 3 nguyên tố không giống đồng ý đổi thay thành nguyên tố thiết yếu của bảng tuần hoàn. Các nguyên tố mới tất cả số hiệu nguim tử là 115, 117, 118. Bởi vậy, cùng rất ngulặng tố 114 với 116, bảng tuần hóa những ngulặng tố chất hóa học hiện giờ có một chu kỳ 7 tương đối hoàn hảo. Lúc chú ý vào trong 1 bảng tuần trả hóa học, sẽ có được các phần bao gồm được biểu thị nlỗi sau:
1. Ô nguyên ổn tố
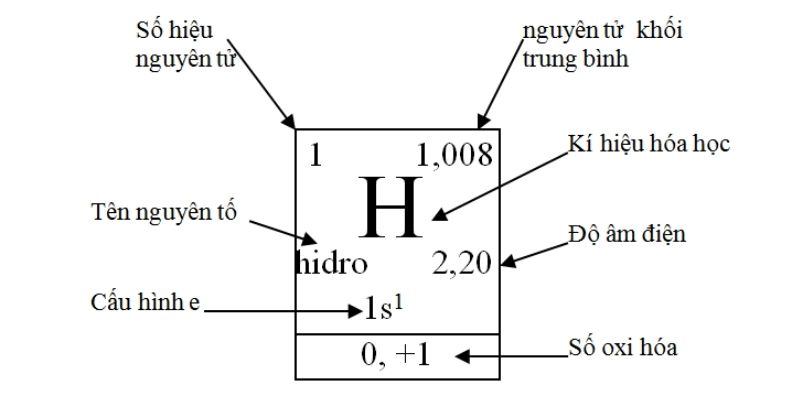
Các nguim tố trong bảng tuần hoàn chất hóa học được trình diễn hết sức rõ ràng cùng chi tiết thành những ô nlỗi hình bên dưới.Mỗi ô gồm những yếu tắc công bố nhỏng sau:
a. Tên nguyên ổn tốTên nguim tố có nghĩa là tên của nguyên tố chất hóa học được viết theo trường đoản cú vựng cổ xưa của tiếng Latin và Hy Lạp. Các ngulặng tố này được minh bạch cùng nhau bằng số hiệu ngulặng tử hoặc số proton bao gồm trong phân tử nhân của từng nguim tử nguyên tố đó.
b. Ký hiệu chất hóa họcKý hiệu chất hóa học đó là viết tắt tên của của một nguyên tố. thường thì cam kết hiệu chất hóa học đã tất cả có từ 1 đến hai chữ cái vào bảng vần âm Latin. Chữ dòng thứ nhất của ký kết hiệu chất hóa học vẫn là chữ cái viết hoa, còn chữ cái còn sót lại sẽ tiến hành viết thường.

Số hiệu nguyên tử cho thấy thêm số proton của một nguim tố bao gồm trong vào hạt nhân của một nguyên ổn tử. Số này cũng đó là số điện tích phân tử nhân (điện tích dương) của nguyên tử nguim tố kia. Vì số hiệu nguim tử của một nguim tố là độc nhất nên phụ thuộc số này, chúng ta cũng có thể dễ dàng khẳng định được thương hiệu của nguyên ổn tố yêu cầu kiếm tìm. Ngoài ram khi 1 nguim tử ko tích điện, thì số electron của lớp vỏ sẽ bởi với số hiệu nguyên tử.
Lưu ý: Số thiết bị từ ô ngulặng tố = số hiệu nguyên tử ( số e= số p= số năng lượng điện hạt nhân)
d. Nguyên tử khối hận trung bìnhNguim tử kân hận vừa đủ là cân nặng vừa đủ của hỗn hợp những đồng vị của nguim tố đó theo một Phần Trăm Tỷ Lệ các nguim tử nhất định.
e. Độ âm năng lượng điệnĐộ âm năng lượng điện của một ngulặng tử ngulặng tố hóa học là kỹ năng hút electron của nguim tử nguim tố kia nhằm tạo nên các liên kết hóa học. Do đó, Lúc độ âm điện của nguyên tử nguyên tố đó càng lớn thì tính phi klặng sẽ càng bạo phổi và ngược trở lại, nếu như độ âm điện của nguim tử càng nhỏ thì tính phi klặng đã nhỏ dại tuyệt tính sắt kẽm kim loại đang dạn dĩ.
f. Cấu hình electron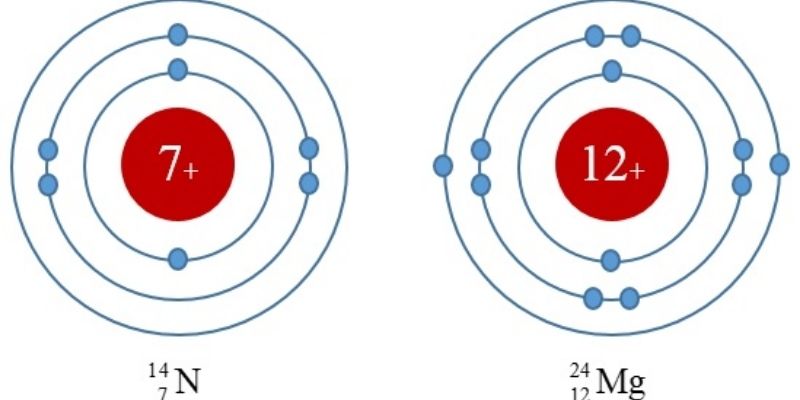
Cấu hình electron tốt còn gọi là thông số kỹ thuật điện tử, nguyên ổn tử biểu thị sự phân bổ những electron bao gồm trong lớp vỏ nguim tử nguyên tố kia sinh hoạt phần đông tinh thần tích điện không giống nhau.
g. Số oxi hóaSố thoái hóa cho biết thêm số electron mà một hay những ngulặng tử nguyên tố đã đàm phán cùng với nguim tử nguim tố khác Lúc tsay đắm gia vào một phản nghịch ứng thoái hóa khử.
Xem thêm: Những Hình Ảnh Bất Cần Đời, Stt Bất Cần Đời Độc Và Đểu, Vui Buồn Ngẫu Hứng
2. Chu kỳ
a. Định nghĩaChu kỳ là một trong hàng các nguim tố chất hóa học mà lại nguyên ổn tử ngulặng tố đó có thuộc số lớp e được thu xếp theo chiều tăng ngày một nhiều năng lượng điện hạt nhân.
b. Phân một số loại chu kỳ luân hồiHiện tại bảng tuần trả nguyên ổn tố chất hóa học gồm có 7 chu kỳ:
Chu kỳ 1, 2 cùng 3 được call là chu kỳ bé dại.
Chu kỳ 4,5,6 và 7 được call là chu kỳ lớn. Trong số đó, chu kỳ luân hồi 7 vẫn chưa được hoàn thành xong.
Trong đó:
Chu kỳ 1: gồm 2 nguyên ổn tố là Hidro ( Z=1) và Heli (Z=2).
Chu kỳ 2: có 8 ngulặng tố từ bỏ Liti (Z=3) đến Neon (Z=10).
Chu kỳ 3: tất cả 8 nguyên tố tự Natri (Z=11) cho Argon (Z=18).
Chu kỳ 4: tất cả 18 nguyên tố từ Kali (Z=19) mang lại Krypton (Z=36).
Chu kỳ 5: bao gồm 18 nguim tố từ Rubidi (Z=37) mang lại Xenon (Z=54).
Chu kỳ 6: gồm 32 nguyên tố từ bỏ Xeđê mê (Z=55) đến Ranon (Z=86).
Chu kỳ 7: ban đầu trường đoản cú nguyên tố Franxi (Z=87) mang đến nguyên tố Z=110.
c. Tính hóa học chu kỳ luân hồi Trong bảng tuần hoàn chất hóa học, những nguyên tố và một một chu kỳ luân hồi sẽ sở hữu số lớp electron cân nhau với bằng số thiết bị từ chu kỳ luân hồi. Một chu kỳ luân hồi sẽ ban đầu xuất phát từ một kim loại kiềm cùng ngừng bởi một nguyên ổn tố khí hãn hữu. Hai hàng cuối của bảng tuần trả chất hóa học là nhì họ nguyên tố gồm cấu hình e đặc biệt là : chúng ta Lachảy có 14 nguim tố thuộc chu kỳ luân hồi 6 với chúng ta Actini có 14 nguyên tố thuộc chu kỳ luân hồi 7.3. Nhóm (nguim tố)
a. Định nghĩaNhóm nguyên tố hay còn được viết tắt là team, là tập hợp tất cả những nguyên tố mà nguyên ổn tử của chính nó bao gồm thông số kỹ thuật electron giống như giống hệt, thế nên đặc thù chất hóa học của bọn chúng cũng gần như giống nhau. Các nguyên tố điều này sẽ được xếp thành một cột, cùng được gọi bình thường là 1 trong những team.
b. Phân các loại team ngulặng tốBảng tuần hoàn hóa học được tạo thành 8 đội A và 8 team B (riêng rẽ team VIIIB bao gồm 3 cột).
Nhóm A: tất cả ngulặng tố team s cùng nguim tố team p. Các ngulặng tố của tập thể nhóm này còn có số từ đội bằng với số lớp e ngoại trừ cùng.
Nhóm B: có những nguim tố team d với team f. Các nguyên tử nguyên tố của những team này thường thì sẽ sở hữu cấu hình e quanh đó thuộc ở dạng (n-1)dxnsy . Lúc kia, biện pháp khẳng định team của những ngulặng tố này sẽ tiến hành triển khai như sau:
+ Trường hợp 1: Tổng (x+y) có mức giá trị tự 3 mang lại 7 thì nguyên tử ngulặng tố này đang nằm trong đội (x+y)B. + Trường phù hợp 2: Tổng (x+y) có giá trị tự 8 cho 10 thì nguyên tử nguyên tố sẽ nằm trong team VIIIB. + Trường vừa lòng 3: Tổng (x+y) có giá trị lớn hơn 10 thì nguyên tử nguyên tố đó sẽ thuộc team (x+y-10)B.Các nguyên tố s, p, d, f vào bảng tuần trả nguim tố hóa học:
Nguim tố s: bao hàm rất nhiều nguim tố team IA và IIA. Các nguyên tử nguyên tố s sẽ sở hữu electron ở đầu cuối được điền vào phân team s.
Ngulặng tố p: bao gồm những nguim tố team IIIA cho team VIIIA ( loại trừ Heli). Electron cuối cùng của nguyên ổn tử ngulặng tố p sẽ tiến hành phân bổ vào phân nhóm p.
Nguyên ổn tố d: là những ngulặng tố trực thuộc team B gồm electron cuối cùng được điền vào phân team d.
Nguyên tố f: là những nguyên ổn tố nằm trong họ Lanchảy và Actini. Tương từ bỏ nlỗi những ngulặng tố trên, nguyên ổn tố f tất cả electron sau cuối được điền vào phân team f.
c. Nhận xét:Ngulặng tử của những nguyên tố cùng đội sẽ có được thuộc số electron hóa trị và số sản phẩm từ bỏ team (trừ 2 nhóm VIIIB sau cuối của bảng tuần hoàn)









